國家藥監局公布,進口醫療器械最新消息
加入日期:2020/10/25 10:47:46 查看人數: 1568 作者:admin
9月25日消息,國家藥監局對外發布《關于進口醫療器械產品在中國境內企業生產有關事項的公告(2020年 第104號)》。
《關于進口醫療器械產品在中國境內企業生產有關事項的公告(2020年 第104號)》
為進一步貫徹落實國務院《關于改革藥品醫療器械審評審批制度的意見》和中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,落實“放管服”改革和優化營商環境要求,全面深化醫療器械審評審批制度改革,推動醫療器械產業高質量發展,更好地滿足公眾健康需求,現就已獲進口醫療器械注冊證產品在中國境內企業生產的有關事項公告如下:
一、適用范圍
進口醫療器械注冊人通過其在境內設立的外商投資企業在境內生產第二類、第三類已獲進口醫療器械注冊證產品的有關事項,適用本公告。
二、注冊要求
(一)進口醫療器械注冊人在中國境內設立的外商投資企業作為注冊申請人,向藥品監督管理部門提交境內醫療器械注冊申請。注冊申請內容,除注冊人名稱、住所、生產地址外,原則上應當與所對應的進口醫療器械注冊證及其附件載明的相關事項保持一致。
(二)注冊申請人按照《醫療器械注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監督管理總局2014年第43號公告)、《體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監督管理總局2014年第44號公告)等要求提交注冊申報資料。其中,醫療器械產品的綜述資料、研究資料、臨床評價資料、產品風險分析資料,體外診斷試劑產品的綜述資料、主要原材料的研究資料(適用時)、主要生產工藝及反應體系的研究資料(適用時)、分析性能評估資料、陽性判斷值或參考區間確定資料、穩定性研究資料、臨床評價資料、產品風險分析資料,可提交進口醫療器械的原注冊申報資料。進口注冊人和境內注冊申請人應當確保上述資料與本次注冊申請的相關性和支持性。
(三)注冊申報程序按照《醫療器械注冊管理辦法》《體外診斷試劑注冊管理辦法》以及醫療器械電子申報相關規定執行。
(四)按照本公告要求提交注冊申請并獲得批準的,注冊證備注欄中應當載明相關已獲準注冊的進口產品的醫療器械注冊證號。
三、注冊體系核查要求
注冊申請人應當確保境內生產包含產品的主要生產工藝,并承諾主要原材料和生產工藝不發生改變,提供產品在境內生產質量管理體系符合我國《醫療器械生產質量管理規范》的自查報告和境內外質量管理體系等同性對比報告。藥品監管部門按照醫療器械注冊質量管理體系核查工作程序,對境內注冊申請人開展全面核查,重點關注境內外質量管理體系的等同性、溯源性,以及變更生產過程帶來的體系變化是否會產生新的風險,引起注冊事項的變更。
四、上市后監管要求
境內注冊人應當按照《醫療器械生產監督管理辦法》辦理醫療器械生產許可證,嚴格落實質量安全主體責任,加強醫療器械全生命周期質量管理;按照《醫療器械生產質量管理規范》要求,建立健全質量管理體系并保證有效運行。
五、其他方面
中國境內企業投資的境外注冊人在境內生產已獲進口醫療器械注冊證的第二類、第三類醫療器械產品的,參照本公告執行,由投資境外注冊人的中國境內企業作為注冊申請人申請該產品注冊。
香港、澳門、臺灣地區已獲醫療器械注冊證的產品有關事項參照本公告執行。
本公告自公告之日起施行。
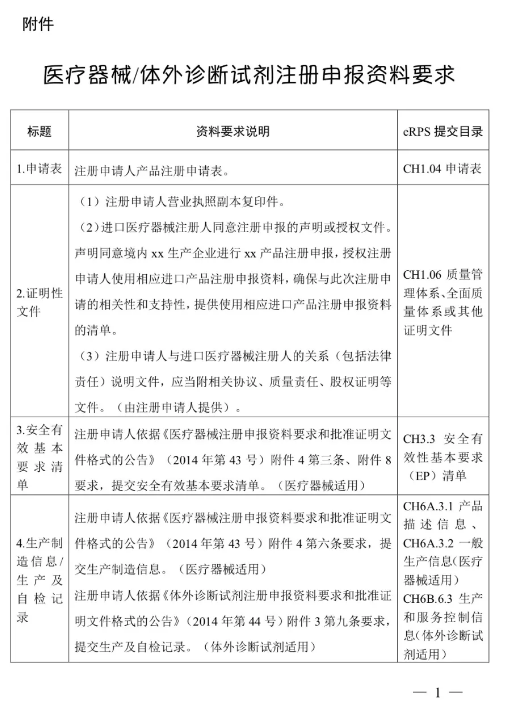
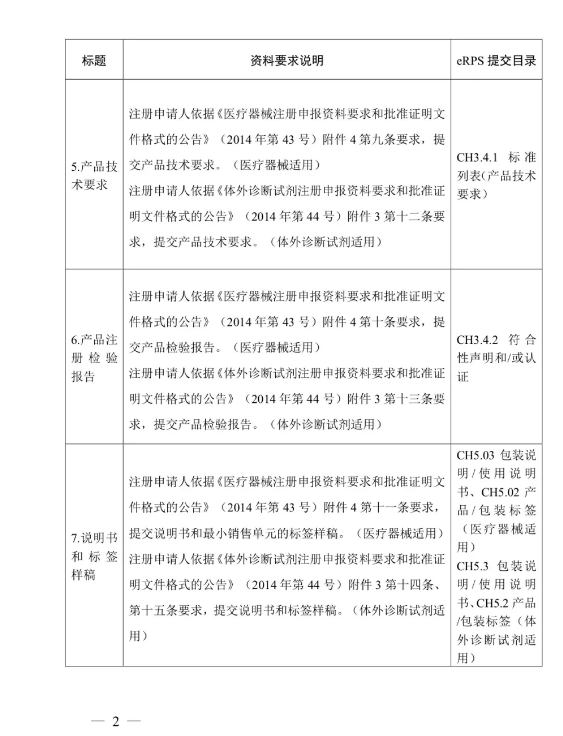
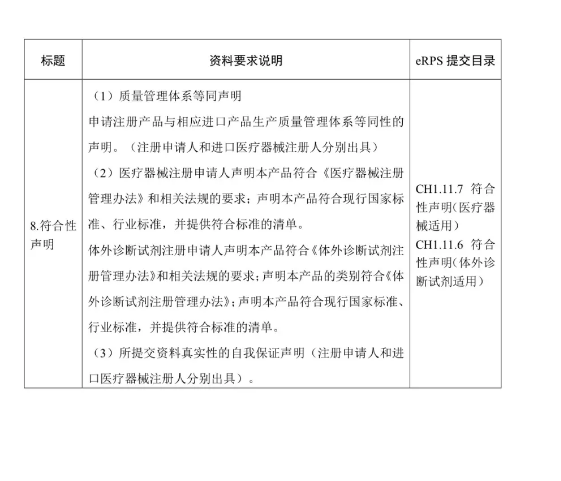
附件:醫療器械/體外診斷試劑注冊申報資料要求
國家藥監局
2020年9月18日
附件:醫療器械/體外診斷試劑注冊申報資料要求

 主站蜘蛛池模板:
宝鸡市|
那坡县|
容城县|
观塘区|
楚雄市|
洪雅县|
丘北县|
衡阳县|
佛学|
万盛区|
汽车|
禄劝|
黄大仙区|
钦州市|
荥经县|
余庆县|
嘉峪关市|
津市市|
乌兰浩特市|
湖南省|
龙里县|
崇阳县|
旺苍县|
资中县|
信丰县|
延边|
灵石县|
岳普湖县|
田林县|
米泉市|
治县。|
长武县|
陕西省|
中山市|
乐平市|
枞阳县|
友谊县|
石城县|
抚宁县|
茶陵县|
民县|
蓬溪县|
长岭县|
厦门市|
武胜县|
巧家县|
双城市|
子长县|
聊城市|
宜宾县|
彭泽县|
乌苏市|
玉田县|
陆丰市|
清苑县|
左权县|
庄河市|
庆阳市|
古田县|
南召县|
阿克陶县|
洛阳市|
德州市|
台湾省|
桑日县|
澳门|
德格县|
个旧市|
牡丹江市|
南靖县|
道孚县|
济南市|
丽江市|
绥德县|
临夏市|
色达县|
长寿区|
崇左市|
顺昌县|
牡丹江市|
连南|
增城市|
主站蜘蛛池模板:
宝鸡市|
那坡县|
容城县|
观塘区|
楚雄市|
洪雅县|
丘北县|
衡阳县|
佛学|
万盛区|
汽车|
禄劝|
黄大仙区|
钦州市|
荥经县|
余庆县|
嘉峪关市|
津市市|
乌兰浩特市|
湖南省|
龙里县|
崇阳县|
旺苍县|
资中县|
信丰县|
延边|
灵石县|
岳普湖县|
田林县|
米泉市|
治县。|
长武县|
陕西省|
中山市|
乐平市|
枞阳县|
友谊县|
石城县|
抚宁县|
茶陵县|
民县|
蓬溪县|
长岭县|
厦门市|
武胜县|
巧家县|
双城市|
子长县|
聊城市|
宜宾县|
彭泽县|
乌苏市|
玉田县|
陆丰市|
清苑县|
左权县|
庄河市|
庆阳市|
古田县|
南召县|
阿克陶县|
洛阳市|
德州市|
台湾省|
桑日县|
澳门|
德格县|
个旧市|
牡丹江市|
南靖县|
道孚县|
济南市|
丽江市|
绥德县|
临夏市|
色达县|
长寿区|
崇左市|
顺昌县|
牡丹江市|
连南|
增城市|